Les organoïdes rétiniens, une technologie en plein essor
L’Institut de la Vision va agrandir sa salle de culture dédiée aux organoïdes. Un investissement à la hauteur des promesses scientifiques et thérapeutiques portées par ces tissus rétiniens cultivés en laboratoire qui transforment la recherche biomédicale.

Un modèle humain standardisable… et breveté
La recherche en ophtalmologie est rentrée dans une nouvelle ère grâce aux organoïdes rétiniens : des structures tridimensionnelles issues de cellules souches humaines, reprogrammées à partir d’un simple prélèvement de peau. Les organoïdes reproduisent l’organisation et le fonctionnement du tissu rétinien, tout en étant accessibles, reproductibles et adaptables à différents protocoles expérimentaux. Ce modèle cellulaire est aujourd’hui au cœur de nombreuses approches innovantes et facilite la mise en œuvre de projets de recherche. Parce qu’ils reproduisent fidèlement la physiologie humaine, ces avatars de rétine humaine constituent un levier puissant pour la recherche sur les maladies génétiques. En introduisant une mutation via l’édition génomique (CRISPR-Cas9, une méthode permettant de modifier précisément l’ADN) ou en cultivant les cellules d’un patient porteur de la mutation, il devient possible de comparer à fond génétique constant des organoïdes sains et pathologiques. Une avancée méthodologique majeure pour mieux comprendre les mécanismes à l’origine des maladies rétiniennes.
« On peut désormais produire facilement en laboratoire et à grande échelle, congeler et décongeler des cellules de rétine. »
Sacha Reichman, Responsable de groupe
La recherche en mode accéléré
Le groupe dirigé par Sacha Reichman au sein de l’équipe d’Olivier Goureau (Développement et régénération de la rétine) a développé une méthode de culture simplifiée et brevetée, fondée sur une transition progressive des milieux de culture sans manipulations complexes. Associé à des techniques avancées de cryoconservation, le groupe propose une véritable bibliothèque de cellules rétiniennes humaines – photorécepteurs, cellules pigmentées, progéniteurs – pour modéliser les maladies dégénératives. Dans les recherches du groupe pour le développement de traitements pharmacologiques, ces cellules sont utilisées pour tester des milliers de molécules à potentiel thérapeutique en un temps réduit. Les organoïdes permettent ensuite de valider les molécules candidates et d’augmenter l’efficacité du criblage à haut débit. Une fois une piste thérapeutique identifiée par les chercheurs, l’imagerie en temps réel développée par l’équipe de Kate Grieve (Imagerie en direct chez les patients et les cellules) permet de suivre l’évolution d’un organoïde sur plusieurs semaines et l’impact éventuel du traitement, de manière dynamique et prédictive.
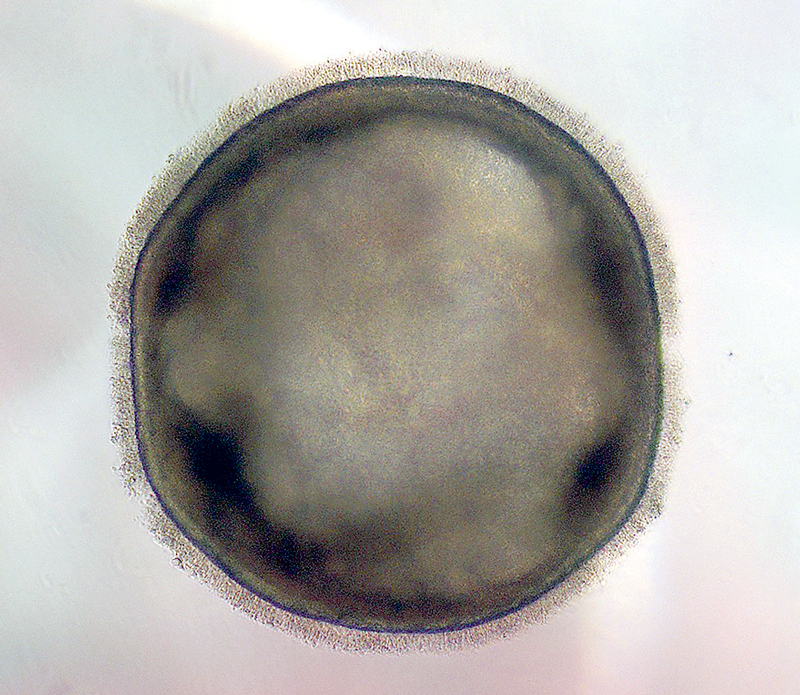
« Les organoïdes permettent d’étudier spécifiquement diverses mutations génétiques impliquées dans les dégénérescences rétiniennes. Leur environnement tridimensionnel reflète bien la complexité tissulaire de la rétine humaine. »
Deniz Dalkara, Directrice de recherche
Un nouveau paradigme pour les thérapies géniques et cellulaires
Dans les recherches de Deniz Dalkara (équipe Thérapies géniques et modèles des maladies neurodégénératives), les organoïdes rétiniens s’imposent comme un modèle puissant pour donner un nouvel élan à la thérapie génique. Ils permettent d’explorer l’effet de mutations spécifiques, de tester l’efficacité et la toxicité des vecteurs qui transportent le gène-médicament, et ce dans un environnement très proche de la rétine humaine. Bien qu’ils ne puissent se substituer totalement aux modèles animaux, notamment pour évaluer les interactions immunitaires ou la durabilité des effets d’une thérapie, ils permettent d’en réduire drastiquement l’usage et d’y recourir de manière beaucoup plus ciblée.
Pour la thérapie cellulaire, les travaux d’Olivier Goureau illustrent un autre volet prometteur de l’utilisation des organoïdes : celui de la transplantation de cellules saines pour remplacer des cellules déficientes. Les organoïdes permettent en effet de produire des photorécepteurs en grande quantité, d’étudier leur développement, et de préparer leur transfert au patient. Plusieurs défis restent cependant à relever, notamment garantir la survie à long terme des greffons, limiter les risques de rejet et démontrer un bénéfice fonctionnel clair. Mais les fondations sont solides car les cellules thérapeutiques sont prêtes ; reste à franchir le cap de l’application clinique.
« Grâce aux organoïdes, nous disposons aujourd’hui de plateformes pertinentes pour isoler et purifier des cellules spécifiques, avec un objectif clair, celui de restaurer la vision. »
Olivier Goureau, Directeur de recherche